 Auf der Schleimhaut am harten Gaumen sind deutliche Erosionen erkennbar
Auf der Schleimhaut am harten Gaumen sind deutliche Erosionen erkennbar
| Das Wichtigste in Kürze
Pestivirus aus der Familie der Flaviviridae. Infiziert werden Rinder, Schafe und Wildwiederkäuer. Erkrankungen im Sinne von BVD können bei Tieren aller Altersstufen auftreten, Aborte in verschiedenen Trächtigkeitsstadien können vorkommen. Bei Infektion im 5.-6. Monat der Trächtigkeit können die Kälber zentralnervöse Störungen (okulozerebelläres Syndrom) entwickeln. MD kann nur bei Tieren auftreten, die in den ersten 3-4 Monaten ihres embryonalen bzw. fetalen Lebens, also vor Ausbildung des Immunsystems, mit einem nichtcytopathogenen BVDV-Biotyp infiziert wurden. Sie entwickeln eine Immuntoleranz, bleiben zeitlebens persistent infiziert und scheiden massiv Virus aus. Nach exogener oder endogener (Mutation) Superinfektion mit einem, dem persistierenden ncp Virus antigenetisch sehr ähnlichen, cytopathogenen BVDV-Biotyp tritt nach einer Inkubationszeit von 2-3 Wochen die sogenannte Frühform der MD auf. Bei erheblichem antigenetischem Unterschied des superinfizierenden cp Virus kann es zur Serokonversion kommen, oder es entwickelt sich nach Monaten die sogenannte Spätform der MD. Von spontan auftretender MD sind meist Rinder im Alter von 6-24 Monaten betroffen. Symptome der MD: zunehmende Störung des Allgemeinbefindens, Speicheln, Fieber, profuser Durchfall mit Tenesmus, Faeces mit Blut und Schleim, manchmal wie Serum. Teilweise Erosionen an Flotzmaul, Nasenöffnungen, Maulschleimhaut und im Zwischenklauenspalt. Diagnose klinisch oder Virusnachweis aus Nasentupfern, Blut, Kot oder (Schleim-)Hautbioptaten. Aufgrund der Gegenwart maternaler Antikörper ist der Virusnachweis bei Kälbern nicht immer erfolgreich. MD verläuft immer tödlich, keine Therapie möglich. Anzeigepflicht (s. §). |
Prüfungsstoff
| Erreger | Therapie |
| Epidemiologie und Pathogenese | Prophylaxe |
| Klinische Erscheinungen bei MD | gesetzliche Vorschriften |
| Diagnose | |
| Differentialdiagnose |
Erreger:
Pestiviren aus der Familie der Flaviviridae, eng verwandt oder
identisch mit dem Virus der Border Disease (BDV) und verwandt mit dem Virus der
europäischen oder klassischen Schweinepest. Neuerdings werden die verschiedenen Genotypen von BVDV (BVDV-1 und BVDV-2) als eigene Spezies klassifiziert. Für beide gibt es eine Reihe von Subtypen, die mit kleinen Buchstaben gekenzeichnet werden, z.B. BVDV-1g. Innerhalb der Subtypen können verschiedene Isolate unterschieden werden. Zwischen ihnen können antigenetische
Unterschiede bestehen, die durch die bei RNS-Viren häufigen Punktmutationen oder Rekombinationen entstehen. Bei Rekombinationen kann auch RNS anderer Viren oder gar der Wirtszelle in das Virusgenom integriert werden. Auch hinsichtlich der Virulenz und des Organtropismus bestehen erhebliche Unterschiede zwischen einzelnen Stämmen, wobei die genetische Basis noch unklar ist.
Von allen Stämmen gibt es cytopathogene (cp) und nicht cytopathogene (ncp) Biotypen. Cytopathogene Biotypen töten Zellen in der Zellkultur innerhalb weniger Tage ab. Cp BVDV entstehen durch Rekombination des für das NS2/3-Protein codierenden RNS-Abschnittes (durch Insertion eigener oder fremder RNS), durch Punktmutation im Bereich des N2-Gens, durch Duplikation oder durch Rekombination eines ncp BVDV mit einem cp BVDV. Dies hat den Effekt, dass das Protein in zwei Teile "zerbricht" (NS 2 und NS 3, wobei letzteres für die Zytopathogenität verantwortlich gemacht wird). Rückmutation von cp BVDV zu ncp BVDV ist auch möglich.
Die weiteren Abschnitte werden nach erfolgreicher Beendigung des Tilgungsverfahrens nur noch historisches Interesse haben.
Zur Geschichte:
Die beiden im Namen angedeuteten klinischen Erscheinungsformen wurden
zunächst als separate Krankheiten beschrieben: Bovine Virusdiarrhoe
mit hoher Morbidität (80 - 100 %) und geringer Letalität (0 -
20 %) und Mucosal Disease mit geringer Morbidität (< 10 %) und
hoher Letalität (100 %). Zu Beginn der 60er Jahre wurde erkannt, dass die daran beteiligten
Viren sehr ähnlich oder identisch waren.
Wirtsspektrum: Die Erreger können zwischen Schafen und Rindern ausgetauscht werden. BDV kann von Schafen auf Rinder übertragen werden. Auch Wildwiederkäuer (z.B. Rotwild) können infiziert sein.
Hauptausgangspunkt von Bestandsinfektionen sind persistent infizierte Rinder (s. Pathogenese). Tiere mit akuten Infektionen sind dagegen - falls überhaupt - nur über einen relativ kurzen Zeitraum ansteckend.
Es ist anzunehmen, dass MD unter natürlichen Bedingungen nur bei solchen Tieren auftritt, die in den ersten drei bis vier Monaten ihres embryonalen oder fetalen Lebens (also vor Reifung des Immunsystems) durch ein ncp BVDV infiziert worden sind, gegenüber diesem Virus humorale und zelluläre Immuntoleranz zeigen, es zeitlebens beherbergen (persistente Infektion, PI) und massiv ausscheiden. Die Immuntoleranz ist sehr spezifisch. Die Fähigkeit zu humoraler oder zellulärer Reaktion gegenüber anderen Antigenen ist nicht beeinträchtigt. Die Häufigkeit dieser persistent virämischen Tiere liegt theoretisch bei etwa 3 %, tatsächlich meist darunter. So wurden in einer größeren Studie in Niedersachsen 2,1 % Rinder mit pI gefunden. In einzelnen Betrieben kann jedoch durch besondere Umstände eine ganze Serie von persistent virämischen Kälbern anfallen (in einem Betrieb in Nordniedersachsen über 20). Persistent virämische Rinder können klinisch völlig unauffällig bleiben und sich normal fortpflanzen. Weibliche "Virämiker" bringen dann jedoch stets wiederum persistent virämische Kälber zur Welt. Öfters bleiben PI-Rinder aber mehr oder weniger deutlich im Wachstum zurück. Der Grund dafür ist nicht eindeutig geklärt. Möglicherweise hängt das Kümmern mit einer Störung der Schilddrüsenfunktion zusammen (Larsen et al., 1995). PI ist bisher nur durch ncp BVDV nachgewiesen. Möglicherweise führt eine Infektion des Embryos oder Fetus mit cp BVDV zum Tod.
Zur Entwicklung der praktisch stets tödlich verlaufenden Mucosal
Disease kommt es dann, wenn ein derartig persistent infiziertes Tier eine
exogene (oder endogene, durch Mutation) Superinfektion mit einem antigenetisch
identischen oder sehr ähnlichen, aber cytopathogenen (cp) Biotyp von
BVDV erfährt. In diesem Fall tritt nach einer "Inkubationszeit" von
zwei bis drei Wochen die sogenannte Frühform der MD auf.
Unterscheiden sich persistentes ncp-Virus und das cp-Virus der Superinfektion
antigenetisch erheblich, kann es zu Serokonversion kommen (wobei
das PI-Rind Antikörper in niedrigen Titern gegen diejenigen Antigene
des cp-Virus bildet, hinsichtlich derer es sich vom persistenten ncp-Virus
unterscheidet; dies geschieht auch, wenn aus dem BVDV der PI durch Mutation antigenetisch abweichende Varianten entstehen). Oder es entwickelt sich nach Monaten die sogenannte Spätform
der MD, weil es in Zellen, die von beiden Virustypen infiziert waren, zur
Rekombination gekommen ist, mit dem Ergebnis, dass cp-Virus mit den
antigenetischen Eigenschaften des persistenten ncp-Virus vorhanden ist.
Von MD betroffen sind meist Rinder im Alter von
6 bis 24 Monaten.
Der ncp Biotyp ist der natürliche, der sich im Wirt rascher vermehrt
und leichter weitergegeben wird. Der cp Biotyp ist als molekularbiologischer
"Unfall" anzusehen und ist epidemiologisch eine "Sackgasse".
So ist bisher auch keine PI mit einem cp BVDV nachgewiesen. Ob cp BVDV die Placenta weniger gut passieren kann als ncp BVDV, ist nicht klar. Infektion der Frucht mit cp BVDV führt zum Tod der Frucht.
Bricht BVDV in einen "jungfräulichen" Bestand ein, kann es zu einer
Ereigniskaskade kommen, die in Laufställen rascher als in Anbindeställen
abläuft. Zunächst können klinisch manifeste Erkrankungen
im Sinne von BVD auftreten, auch mit Todesfällen bei Tieren aller
Altersstufen. Dann können Aborte in verschiedenen Trächtigkeitsstufen
vorkommen, wobei Frühaborte sich nur als unregelmäßiges
Umrindern bemerkbar machen. BVDV infiziert auch die Eierstöcke, was
die Qualität von Oocyten und die Hormonproduktion durch die Eierstöcke
beeinträchtigen kann. Später können Kälber mit zentralnervösen
Störungen (im Sinne des sogenannten okulozerebellären Syndroms
(s. Video unten) auf die Welt kommen, und schließlich kommen (persistent
infizierte) Kälber zur Welt, die zunächst mehr oder weniger unauffällig
sind, aber später kümmern, an Durchfall oder Lungenentzündung
verenden oder Mucosal Disease entwickeln können.
BVDV wurde zumindest in der Vergangenheit auch über kontaminierte
andere Vakzinen in Bestände eingeschleppt. Bei der Produktion von
vielen Virusvakzinen wird Serum von Rinderfeten verwendet, die zu
einem gewissen Prozentsatz mit BVDV kontaminiert sind. Auch bei der Anwendung ist
eine Kontamination denkbar, wenn etwa Revolverspritzen ohne
Zwischensterilisation für verschiedene Impfungen verwendet werden.
Nicht immer lässt sich aus den von den verschiedenen Krankheitsbildern
betroffenen Tieren BVDV isolieren. Das entbindet den Praktiker jedoch nicht
von der Verpflichtung zur gründlichen Abklärung eines Bestandsproblems.
Klinische Erscheinungen bei MD:
Zunehmende Störung des Allgemeinbefindens, Anorexie, Speicheln,
nasser Kehlgang, Fieber, profuser Durchfall mit Tenesmus; die Faeces sehen
manchmal aus wie Serum und gerinnen auch; sonst enthalten sie Blut, Schleim
und mitunter auch Fibrin. Am Flotzmaul, den Naseneingängen, vor allem
aber an der Maulschleimhaut bilden sich mehr oder weniger ausgeprägte
Erosionen. Solche Veränderungen finden sich auch an der Haut im Zwischenklauenspalt.
Die Schleimhaut- und Hautveränderungen sind jedoch nicht in jedem
Fall deutlich.
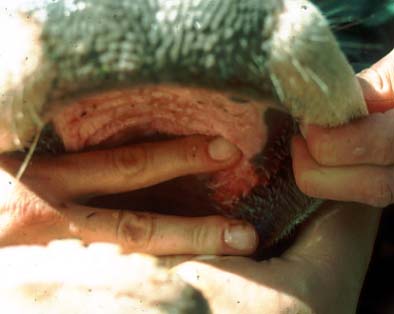
 Auf der Schleimhaut am harten Gaumen sind deutliche Erosionen erkennbar
Auf der Schleimhaut am harten Gaumen sind deutliche Erosionen erkennbar
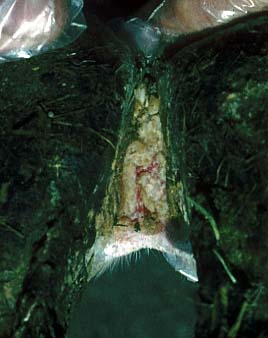 Zwischenklauenspalt: die Haut ist stark erodiert
Zwischenklauenspalt: die Haut ist stark erodiert
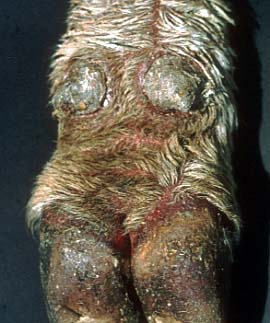 Hautform der MD: diffuse Erosionen im Bereich der Fesselbeuge
Hautform der MD: diffuse Erosionen im Bereich der Fesselbeuge
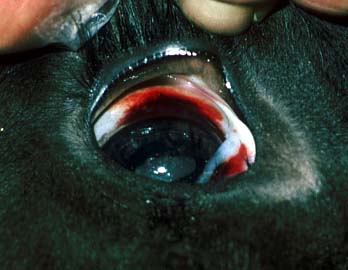 Hämorrhagische Diathese: flächenhafte subsklerale Blutung
Hämorrhagische Diathese: flächenhafte subsklerale Blutung
 Schwere Ataxie bei einem Kalb mit Kleinhirnhypoplasie.
Schwere Ataxie bei einem Kalb mit Kleinhirnhypoplasie.
Video,
37 Sek., 5,8 MB Kalb mit okulozerebellärem
Syndrom: es ist offensichtlich blind (stößt mit dem Kopf gegen
Boxenwand) und kann nicht stehen. Mit dem Kopf führt es schwankende
Bewegungen aus.
Diagnose:
Bei Tieren mit ausgeprägten Erosionen ist die Diagnose klinisch
hinreichend sicher zu stellen. Als Substrate zum Nachweis von Virus, Antigen
oder spezifischen RNS-Sequenzen eignen sich (gerinnungsgehemmtes Blut, (Schleim-)Hautbioptate (mit
weitlumiger Kanüle vom Rand einer Erosion), Nasentupfer, und Kot.
Folgende diagnostische Verfahren stehen zur Verfügung:
Direkter Eregernachweis: Virusisolierung, Antigen-Capture-ELISA, Durchflusszytometrie (FACS), PCR, Immunhistochemie
Nachweis von AK: Virusneutralisationstest, ELISA
Der Infektionsstatus eines Rindes im Hinblick auf BVDV ist in aller Regel mit hinreichender Sicherheit feststellbar. Zweimaliger Virusnachweis im Abstand von mindestens 3 Wochen ist (mit ganz wenigen Ausnahmen) als Beweis für das Vorliegen von PI anzusehen. Problematischer ist die Beurteilung eines noch nicht geborenen Kalbes (etwa in einer zugekauften trächtigen Färse). Ist die Mutter nach dem 7. Monat serologisch und virologisch negativ, ist die Frucht als unverdächtig anzusehen. Ist die (nicht geimpfte) Mutter zu diesem Zeitpunkt serologisch stark positiv, besteht der Verdacht, dass sie ein PI-Kalb trägt ("Trojanische Kuh").
Bei Kälbern ist zu beachten,
dass (je nach Untersuchungsverfahren)
in Gegenwart maternaler Antikörper der Virusnachweis im Blut nicht
immer gelingt, auch wenn das Kalb persistent infiziert ist (sogenannte
diagnostische Lücke). Nach neueren Untersuchungen sollen persistent infizierte
Kälber jedoch durch immunhistochemische Untersuchungen von Hautbioptaten
sowie mittels RT-PCR auch dann erfasst werden können, wenn sie noch kolostrale Antikörper
haben. Die Halbwertszeit kolostraler Antikörper ist bei persistent
infizierten Kälbern deutlich kürzer als bei normalen Kälbern
(bei letzteren etwa 3 Wochen).
Auch bei älteren persistent infizierten Rindern gelingt der Virusnachweis
aus Serum nicht immer.
Als Einblick in den aktuellen Stand eines Betriebes im Hinblick auf
BVDV eignet sich das so genannte Jungtierfenster: Fünf bis 10 Jungtiere
im Alter über 6 Monate (nämlich nach Verschwinden der kolostralen
Antikörper) werden serologisch untersucht. Sind sie alle seronegativ,
war das Virus längere Zeit nicht mehr im Bestand aktiv. Sind (fast)
alle seropositiv, ist mit großer Wahrscheinlichkeit mindestens ein
persistent virämisches Tier im Bestand oder war es bis vor kurzem.
Außerdem haben Tiere in Kontakt mit einem "Virämiker" in der
Regel deutlich höhere Titer als geimpfte Rinder. Das ist jedoch diagnostisch
nicht zu verwerten.
Bei Ergebnissen zwischen den Extremen ist die Altersverteilung von
Bedeutung. Sind nur die älteren Tiere seropositiv, hat es vermutlich
früher einen "Virämiker" im Bestand gegeben. Die Aufstallung
der einzelnen Gruppen (mit Einfluss auf mögliche Kontakte) ist
bei der Interpretation der Ergebnisse ebenfalls zu berücksichtigen.
Bei der Interpretation der Ergebnisse serologischer Untersuchungen (also auf AK) ist zu beachten, dass je nach verwendetem Ag Diskrepanzen zwischen den Befunden aus verschiedenen Untersuchungsstellen auftreten können.
Differentialdiagnose:
Hinsichtlich der Stomatitis: BKF, Verätzungen, Stomatitis papulosa.
Hinsichtlich der Enterocolitis: Salmonellose, Kokzidiose.
Therapie:
Mucosal Disease verläuft tödlich. Behandlungsversuche grenzen
an Betrug.
§:
Maßgeblich ist die Verordnung zum Schutz der Rinder vor einer Infektion mit dem Bovinen Virusdiarrhoe-Virus (BVDV-Verordnung),
der Verordnung (EU) 2016/429 und der
Durchführungsverordnung (EU) 2018/1882 sowie der Delegierte
Verordnung (EU) 2020/689
(Fundstelle: www.gesetze-im-internet.de/bvdvv/index.html)
Die V haben die landesweite Tilgung von BVDV zum Ziel.
In diesen Verordnungen wurde erstmals auf eine amtliche Sammlung von Methoden zur Untersuchung aud eine Rierseuchenerreger hingewiesen.
Bei der Definition von BVDV-Unverdächtigkeit geht der V-Geber davon aus, dass PI nicht postnatal erworben werden kann, dass BVDV bei akuten postnatalen Infektionen nicht länger als 40 d nachgewiesen werden kann, und dass PI-Rinder immer PI-Kälber gebären (BVDV-Freiheit eines Kalbes auch BVDV-Freiheit des Muttertiers bedeutet).
Alle neugeborenen Kälber müssen innerhalb des ersten Lebensmonats untersucht werden.
Impfungen sind möglich, an bestimmte Bedingungen gebunden und müssen ins Bestandsregister eingetragen werden.
Die zuständige Behörde kann Impfungen anordnen oder verbieten, die Untersuchung von Rindern und die Tötung von BVDV-positiven Rindern anordnen.
Neu (2020) ist, dass für Mitgliedsstaaten und Zonen der Status 'frei von BVD' von der EU-Kommission und für einen Betrieb 'frei von BVD' durch die zuständige Behörde, erteilt werden kann (hier besteht dann jeweils Impfverbot).
Letzte Änderung: 06.06.2020
home-page
Inhaltsverzeichnis
© Copyright 2018, Klinik für Wiederkäuer, Ludwig-Maximilians-Universität
München