
| Das Wichtigste in Kürze
Erreger: Europäische, schafassoziierte Form: ovines Herpesvirus 2; afrikanische, mit Gnus und Kuhantilopen assozierte Form: alcelaphines Herpesvirus 1, beide aus der Familie der Herpesviridae. Befallen werden vor allem Wiederkäuer, bei Rindern sind meist einzelne junge erwachsene Tiere betroffen. Klinik: Depression, Leistungsrückgang, hohes Fieber, Nasenausfluss, Konjunktivitis und Keratitis mit beidseits symmetrischer, zentripetal fortschreitender Trübung der Kornea, ausgeprägte Veränderungen an Flotzmaul und Maulschleimhaut. Hautveränderungen. Häufig deutliche Vergrößerung der Lymphknoten. Zentralnervöse Störungen sind möglich. Meist Tod wenige Tage nach Auftreten der klinischen Symptome, aber auch perakuteTodesfälle. Schafe zeigen keinerlei Krankheitserscheinungen. Diagnose klinisch und anhand epidemiologischer Gesichtspunkte, Absicherung durch Nachweis einer OvHV2-spezifischen Sequenz in den Leukozyten. Differentialdiagnosen: Infektiöse Keratokonjunktivitis, MD, Verätzungen, (MKS). Letalität auch nach symptomatischer Therapie hoch. Nach klinischer Heilung sind Rückfälle mit tödlichem Verlauf auch nach längerer Zeit möglich. |
Prüfungsstoff
| Erreger | Diagnose |
| Epidemiologie | Differentialdiagnosen |
| Pathogenese | Therapie |
| Klinik | Prophylaxe |
| gesetzliche Vorschriften |
Erreger:
Ovines Herpesvirus 2 (OvHV2) bei der europäischen, schafassoziierten
Form und Alcelaphines Herpesvirus-1 (AlHV-1) bei der afrikanischen Form,
die mit Gnus (Wildebeest, Connochaetes taurinus und C. gnou)
und Kuhantilopen (Hartebeest, Alcelaphus buselaphus, Kaama, Kongoni)
assoziiert ist. Beides sind Gammaherpesviren. Das Genom von OvHV-2 ist komplett sequenziert.

Mit Hilfe von Gensonden (auf der Basis
von PCR = Polymerase Chain Reaction) kann die Anwesenheit von ovinem
Herpesvirus-2 (OvHV2) in Rindern mit BKF und in Schafen, mit denen sie
Kontakt hatten, nachgewiesen werden. In den meisten klinischen Verdachtsfällen
verläuft die Untersuchung positiv.
Mit AlHV1 lässt sich die Krankheit bei Rindern experimentell
auslösen.
In den USA ist ein weiteres Gammaherpesvirus beschrieben worden, das BKF beim Weißwedelhirsch (Odocoileus virginianus) verursacht. Es ist mit OvHV2 und AlHV1 verwandt, aber mit keinem von beiden identisch.
Epidemiologie:
Die Krankheit befällt vor allem Wiederkäuer. Empfänglich
sind neben Boviden, Bisons, Wasserbüffel, andere Wild- und Zoowiederkäuer und Ziegen. Auch Schweine können erkranken. Experimentell lassen sich Kaninchen infizieren.
Meist sind einzelne
junge erwachsene Rinder, sehr selten Kälber, betroffen; es können jedoch auch Enzootien
auftreten, in deren Verlauf bis zu 50 % der Rinder eines Bestandes erkranken.
Die Letalität ist unter erkrankten Rindern hoch, meist über 90 %. In den meisten Fällen sterben die Tiere innerhalb weniger (meist 4 -
10) Tage
nach Auftreten klinischer Erscheinungen, mitunter auch abrupt ohne vorherige
deutliche klinische Phase. Nicht alle infizierten Rinder entwickeln jedoch BKF, auch
wenn sie Serokonversion zeigen. Antikörper schützen aber nicht vor der Erkrankung (zumindest nicht bei Bisons). Selten tritt nach leichteren Erscheinungen eine
Besserung ein, die wochenlang oder gar über ein Jahr anhalten kann. In vielen Fällen kommt
es jedoch dann zu einem Rezidiv mit tödlichem Ausgang, was dafür spricht, dass es zur persistierenden Infektion gekommen war. In jüngerer
Zeit wurde auch eine chronische Form beschrieben.
Ein Kontakt zu Schafen lässt sich meist, aber nicht immer sicher nachweisen. Schafe zeigen keinerlei Krankheitserscheinungen. Das Virus ist aber bei ihnen weit verbreitet. Nach neueren österreichischen Untersuchungen scheinen heimische Wildwiederkäuer (Rot-, Dam-, Reh- und Gamswild) keine Bedeutung als Virusreservoir zu haben.
Der Übertragungsmodus ist noch nicht geklärt. Experimentell ist Übertragung mit Blut und isolierten Leukozyten, und Aerosol aus Nasensekret von Schafen möglich. Die Inkubationszeit beträgt unter diesen Umständen im Mittel etwa 30 Tage (18 bis 73 Tage), unter "natürlichen" Bedingungen variiert sie noch stärker (bis etwa sechs Monate).
In betroffenen Beständen lassen sich mit PCR OvHV2-spezifische Sequenzen im Blut von erkrankten und gesunden Rindern und gesunden Schafen nachweisen. Da der Nachweis bei erkrankten Rindern jedoch nicht immer gelingt, stellt sich die Frage, ob es noch andere Viren gibt, welche BKF-ähnliche Krankheitsbilder verursachen können.
In Afrika spielt sich ein regelmäßiger Kreislauf ab: Wenn
persistent infizierte Kühe der genannten Antilopenarten kalben, kommt
es bei ihnen im Rahmen der peripartalen Immunsuppression zur Reaktivierung
und Ausscheidung des Virus, und sie stecken ihr Kalb an. Bei diesem kommt es zunächst
zu einer zum Teil Monate anhaltenden Virämie. Mit der Ausbildung eines
höheren Antikörperspiegels wird das Virus in seine „Verstecke“
(meist Ganglien) zurückgedrängt, aus denen es erst wieder hervorkommt,
wenn das betreffende Tier selbst kalbt.
Unter Rindern, die in der Nähe von Gnus gehalten werden, kann BKF erhebliche Verluste verursachen.
In Norwegen
ist BKF durch OvHV2 auch bei Schweinen beschrieben worden.
Pathogenese:
Die Tatsache, dass aus einer Gruppe von (vermutlich) gleichartig
exponierten Rindern in aller Regel nur einzelne klinisch manifest an BKF
erkranken, lässt vermuten, dass dabei immunpathologische
Prozesse eine Rolle spielen. So wurde nachgewiesen, dass bei an BKF erkrankten Rinder Interleukin-2 deutlich weniger als bei gesunden Rinder exprimiert wird. IL-2 stimuliert die Bildung von so genannten regulatorischen T-Zellen (Treg), welche Immunreaktionen dämpfen (Braun et al., 2015). Bei Bisons ist Resistenz gegenüber BKF anscheinend mit Polymorphismus bei MHC Klasse IIa assoziiert. Alternativ käme in Frage, dass manche
Tiere über längere Zeit klinisch inapparent infiziert waren,
bevor sie (aufgrund der Einwirkung immunsuppressiver Faktoren?) erkranken. Auch
über eine genetische Prädisposition wird spekuliert.
Klinik:
Die klinischen Erscheinungen sind zum größten Teil Folgen
einer nekrotisierenden und obliterierenden Vaskulitis mit ischämischer
Nekrose der von den betroffenen Gefäßen versorgten Bezirke.
GÖTZE1 hat aufgrund seiner experimentellen
Untersuchungen in der 30er Jahren des vorigen Jahrhunderts vier Verlaufsformen beschrieben (perakute Allgemeinform
mit raschem Verenden, Darmform, Kopf-Augen-Form und leichte Form oder Hautform),
die jedoch nur Abstraktionen aus dem Krankheitsspektrum darstellen. Eine
Mischung aus Kopf-Augen- und Haut-Form wird bei uns am häufigsten
gesehen.
Plötzlich auftretende Niedergeschlagenheit, Anorexie, Versiegen
der Milchproduktion, hohes Fieber, schleimig-eitriger Nasenausfluss,
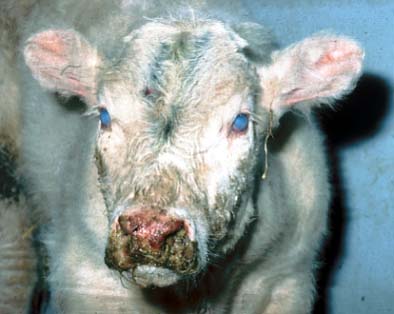
nasale Stenosegeräusche, Augenausfluss, Konjunktivitis und Keratitis
(mit beidseits symmetrischer, zentripetal fortschreitender milchig-grauer
Trübung der Kornea), Lichtscheu, ausgeprägte Veränderungen
an Flotzmaul und Maulschleimhaut. Hautveränderungen können auch
an Zitzen oder am Skrotum, in seltenen Fällen auch generalisiert auftreten.
Die Lymphknoten sind meist deutlich vergrößert. Als Ausdruck
einer nichteitrigen interstitiellen Nephritis und hämorrhagischen Zystitis kann es zu
Hämaturie
und Proteinurie kommen.
Zentralnervöse Störungen: Andrücken mit dem Kopf gegen
Wände, aber auch Tobsuchtsanfälle. Der Liquor ist
vermehrt, mit Erhöhung der Eiweißkonzentration und kann leicht wolkig getrübt
sein.
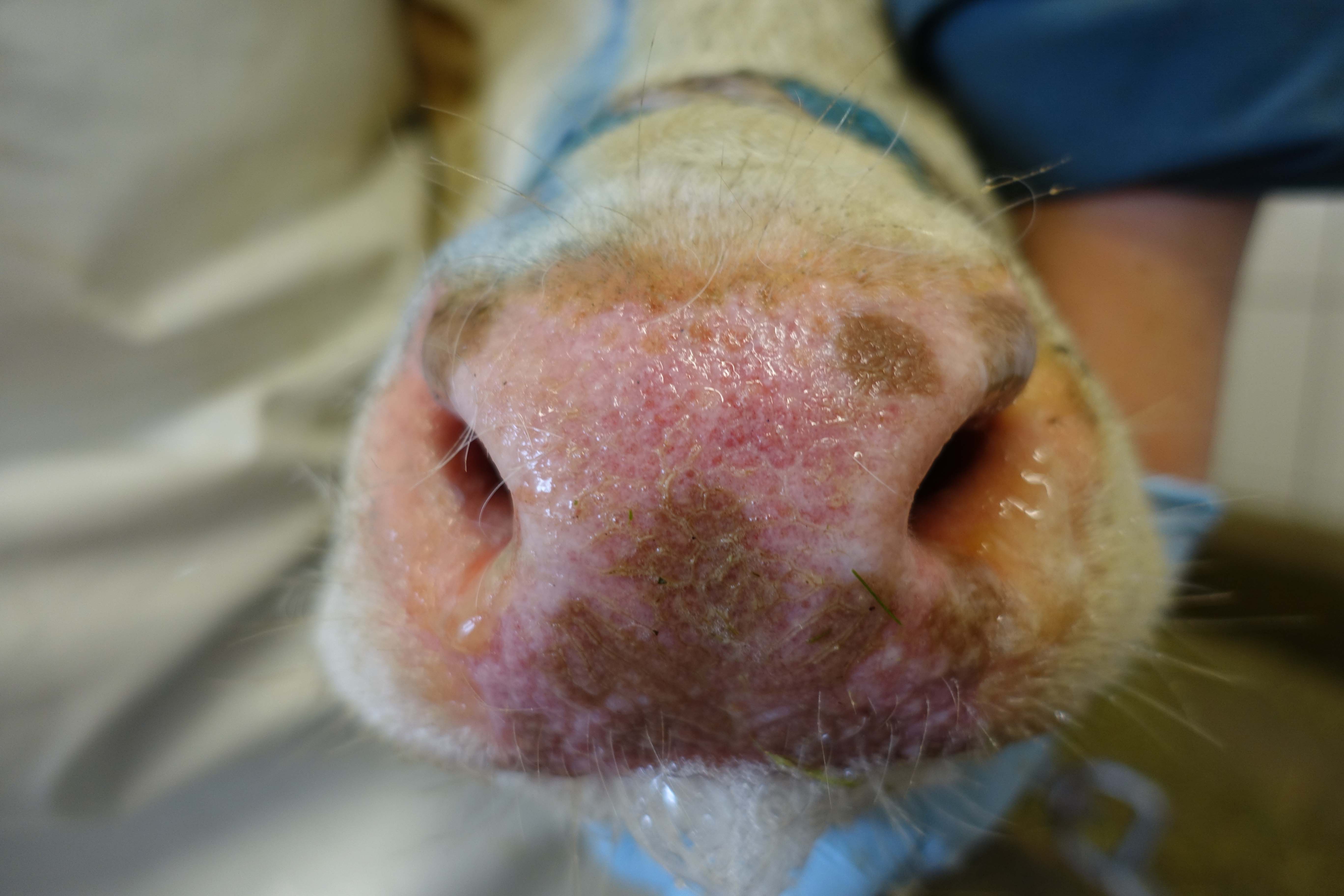
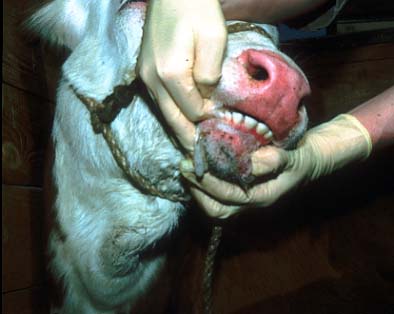
Erosionen am Flotzmaul in verschiedenen Stadien
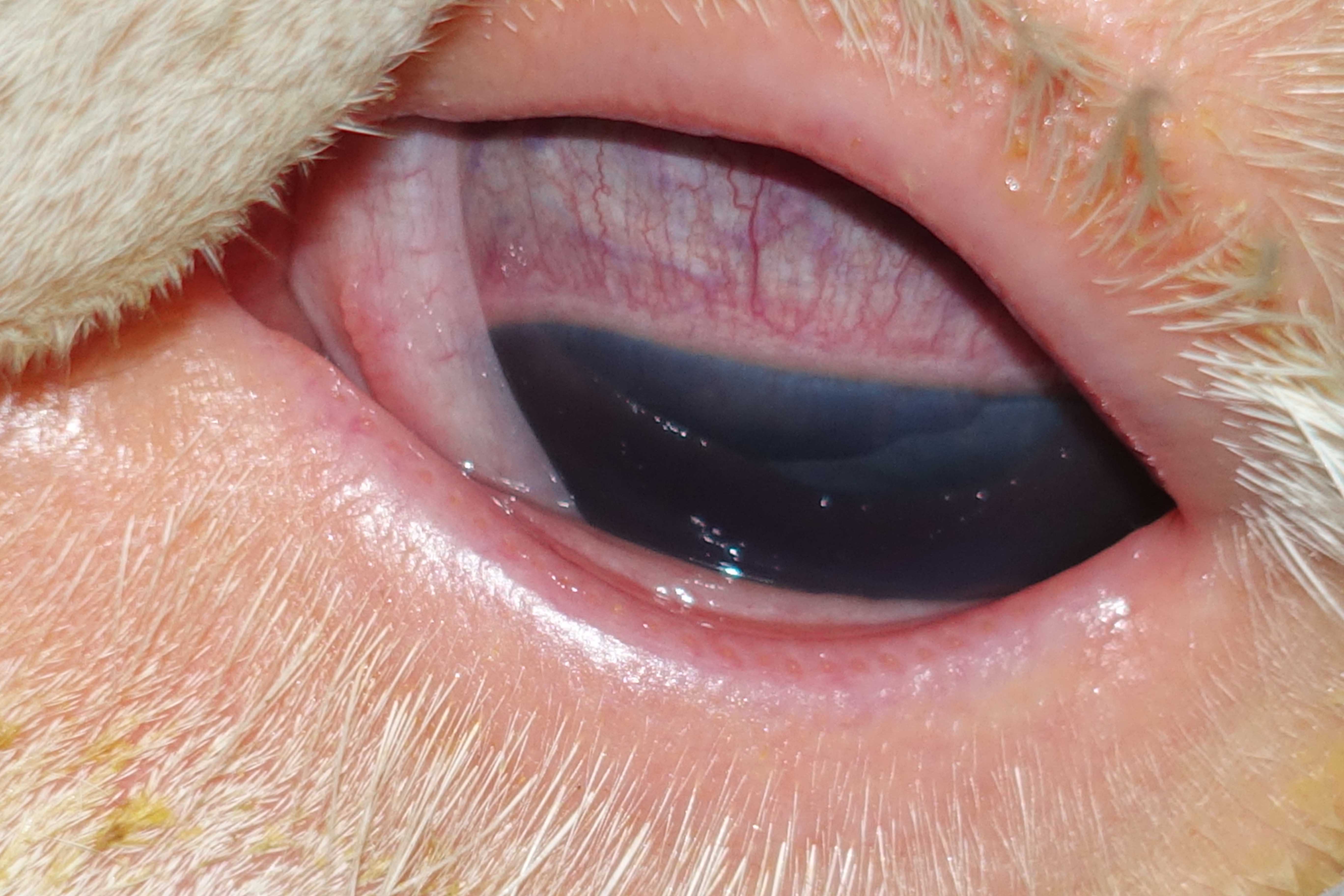
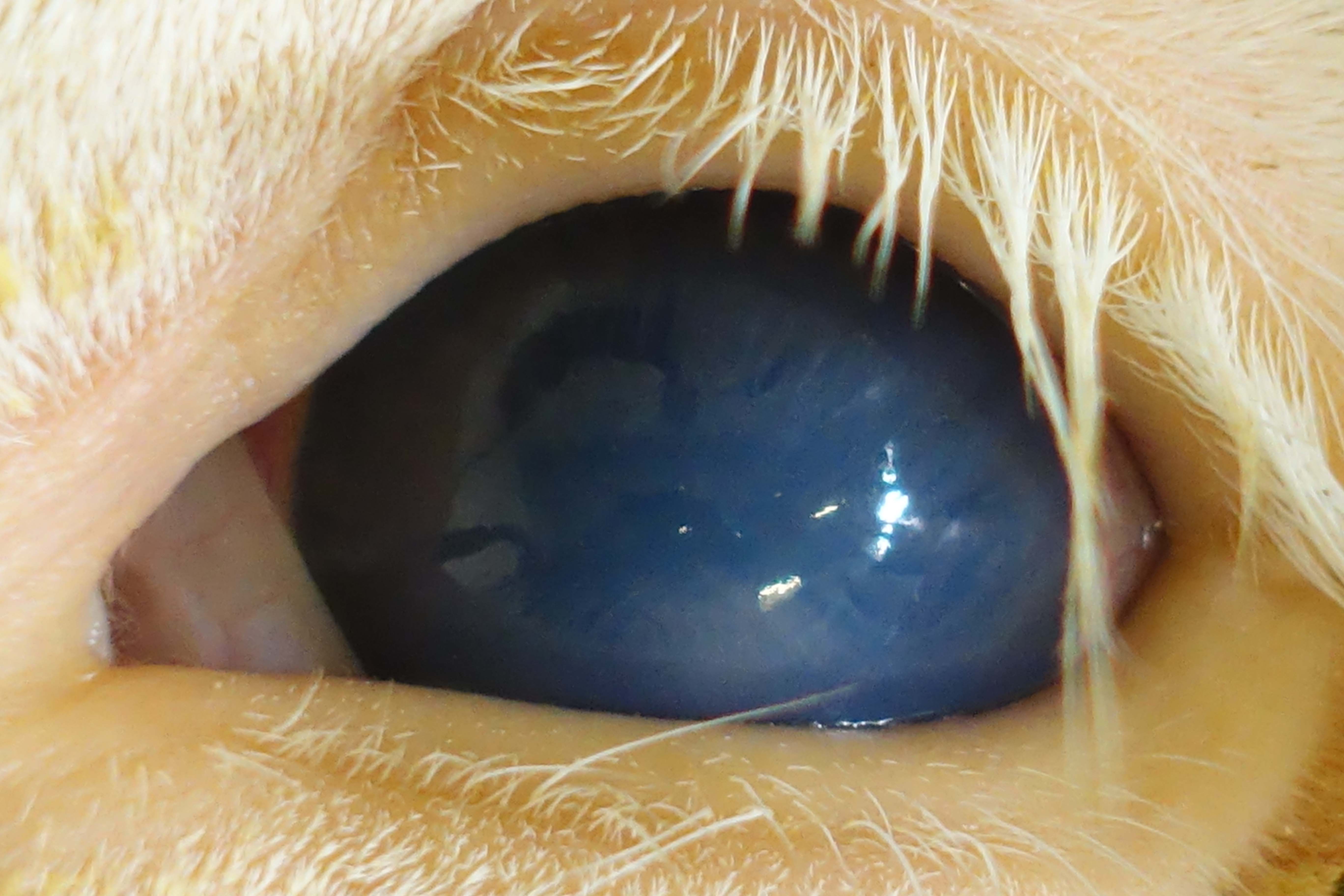
Konjunktivitis und Keratitis
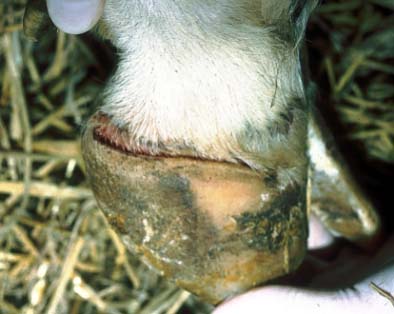
Akutes Ausschuhen
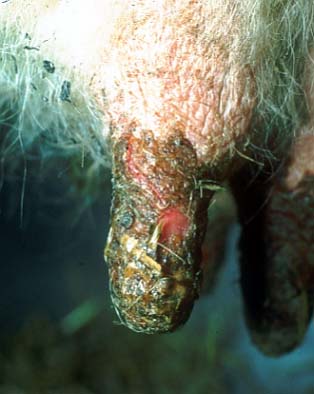
Massive Erosionen an einer Zitze
Die pathologisch nachweisbare nichteitrige Polyarthritis tritt klinisch
nicht in Erscheinung.
Diagnose:
In ausgeprägten Fällen ist aufgrund der klinischen Symptomatik
und der Epidemiologie eine hinreichend sichere Diagnose möglich. Absicherung
durch Nachweis von OvHV2-spezifischer Sequenz in Leukozyten. Einzusenden
ist EDTA-Blut.
Es ist auch ein ELISA zum Nachweis spezifischer Antikörper beschrieben.
Differentialdiagnosen:
Hinsichtlich der Augenveränderungen: Infektiöse bovine Keratonkonjunktivitis (Veränderungen sind meist asymmetrisch).
Hinsichtlich der Stomatitis: Mucosal Disease, Bluetongue, Verätzungen, (MKS).
Therapie:
In älteren Veröffentlichungen wird von relativ guten Behandlungsergebnissen
berichtet (Aderlass, fiebersenkende Mittel, kalte Kopfumschläge,
Heublumenaufgüsse), in neuerer Zeit wird die Letalität auch nach
Therapie mit über 90 % angegeben. Nach Berichten aus der Praxis sind
aber Heilungen nach Anwendung von nicht-steroidalen Antiphlogistika beobachtet
worden.
Auch über Erfolge nach mehrtägiger Anwendung von (unter anderem) 2500 U Interleukin-2 wird berichtet (Braun et al. 2015), wobei allerdings die Konzentration der Lymphozyten bei Behandlungsbeginn eine entscheidende Rolle zu spielen scheint. Deutliche Lymphopenie (< 2,5 G/L) soll mit sehr schlechter Prognose verbunden sein (Braun et al. 2015).
Prophylaxe:
Kontakte zwischen Rindern und Schafen vermeiden.
An Impfstoffen wird gearbeitet.
§:
BKF ist seit 2011 nicht mehr meldepflichtig. Die Krankheit eignet sich aufgrund ihrer epidemiologischen Charakteristik
nicht für eine Bekämpfung. Der durch sie verursachte Schaden
ist auch insgesamt von untergeordneter Bedeutung. In einzelnen Betrieben
kann er jedoch beträchtlich sein.
1 R. Götze (1890-1955): Buiatriker, von 1925 bis 1955
Direktor der "Klinik für Geburtshilfe und Rinderkrankheiten" der Tierärztlichen
Hochschule Hannover.
home-page
Inhaltsverzeichnis
© Copyright 2016, Klinik für Wiederkäuer, Ludwig-Maximilians-Universität
München