Blauzungenkrankheit
Bluetongue
W. Klee
Das Wichtigste in Kürze Durch Arthropoden übertragene Infektion mit BT-Virus, einem Orbivirus. Kommt regional und zeitlich begrenzt bei Wiederkäuern vor. Seit Sommer 2006 auch in Deutschland. Symptomatik: Fieber, Schwellung und bläuliche Verfärbung der Kopfschleimhäute und der Zitzen. Erosionen der Maul-SH, Speicheln. Verlauf bei Rindern sehr unterschiedlich und meist gutartig; bei Schafen mitunter verlustreicher. Anzeigepflicht. |
| Erreger | Diagnostik |
| Epidemiologie | Differenzialdiagnose |
| Pathogenese | Therapie |
| Klinische Erscheinungen | Prophylaxe |
| Prognose | Bekämpfung |
Prüfungsstoff
Erreger:
Bluetongue-Virus (BTV) aus dem
Genus Orbivirus der Familie Reoviridae. Bisher 24 Serotypen beschrieben. Der
Ausbruch im Sommer 2006 in Westeuropa (einschließlich Deutschland) wurde durch den Serotyp 8 verursacht.
Epidemiologie:
Das Wirtsspektrum
umfasst alle Wiederkäuer, vor allem aber Schafe, bei denen die Empfänglichkeit rasseabhängig ist. In Afrika wurden natürliche
Infektionen auch bei Fleischfressern festgestellt. Vermutlich infizieren sie
sich durch Verzehr virämischer Wiederkäuer. Verschiedene Gnitzenspezies der Gattung Culicoïdes
übertragen das Virus beim Blutsaugen. In Deutschland scheint C. obsoletus der wichtigste Vertreter zu sein. Der Ausbruch von BT in Nordwesteuropa 2006 ist nach Angaben des OIE durch C. dewulfi verbreitet worden. In ihren Speicheldrüsen findet auch eine
Vermehrung des Virus statt. Transovarielle Übertragung kommt dagegen nicht vor. Mechanische Übertragung durch andere Arthropoden (Stechmücken, Zecken oder Schaflausfliegen) ist möglich. Direkte Übertragung von Wiederkäuer zu
Wiederkäuer findet nicht statt, mit der möglichen Ausnahme von Sperma von Bullen
in der Phase der Virämie. Aufgrund der Vektorbiologie ist das Vorkommen der
Krankheit örtlich und zeitlich begrenzt; in letzter Zeit tritt sie jedoch auch
in Gebieten außerhalb der Tropen und Subtropen auf, so im Sommer 2006 auch in
den Niederlanden, Belgien, Deutschland und Frankreich. Während in Gebieten mit
endemischem Vorkommen von BT meist ein Gemisch von Serotypen zu isolieren ist,
ist bei Ausbrüchen außerhalb dieser Gebiete meist nur ein Serotyp nachweisbar,
was die Vermutung nahe legt, dass infizierte Gnitzen durch Wind über größere
Strecken transportiert werden. Bei dem Ausbruch in Nordwesteuropa im Sommer 2006
wäre dabei aber zu erwarten, dass auch zwischen dem Mittelmeer und der Gegend,
in welcher der Ausbruch festgestellt wurde, Fälle auftreten. Daher hat Einschleppung über infizierte Trägertiere oder infizierter Gnitzen die größere Wahrscheinlichkeit. Möglicherweise ist die Verbreitung aber größer als es die ersten regional begrenzten Untersuchungen ergaben.
Es wird befürchtet, dass die Infektion dadurch bei uns endemisch werden könnte, dass das Virus aus infizierten Wiederkäuern in der Phase der Virämie (s.u.) über mehrfach verwendete Injektionskanülen auf noch nicht infizierte Wiederkäuer übertragen werden und dadurch das stechmückenfreie Intervall überdauern könnte.
Im Rahmen von umfangreichen Untersuchungen wird offenbar, dass viel mehr Betriebe befallen sind als zunächst angenommen wurde (Januar 2007).
In Spanien und Frankreich haben sich die Verbreitungsgebiete der Serotypen 1 und 8 überlagert (Sommer 2008).
Deutschland gilt seit 15. 2. 2012 als frei von Blauzungenkrankheit.
Pathogenese:
Zunächst vermehrt sich das BTV in regionären Lymphknoten, später kommt es
über zweifache Virämie zur allgemeinen Verbreitung, wobei Hauptort der Vermehrung
Kapillaren und kleine Blutgefäße sind. Folgen sind Gefäßschäden und Hypoxie des
versorgten Gewebes, auch DIC mit haemorrhagischer Diathese (bisher nicht bei Rindern nachgewiesen). In Erythrozyten kann das Virus (oder nur die Virus-RNS) über die Lebensdauer dieser Zellen (bis zu 140 Tage) nachgewiesen werden, obwohl schon etwa 14 Tage post. inf. neutralisierende Antikörper gebildet werden. Die Immunität ist serotypspezifisch (nicht aber die bisher verfügbaren serologischen Verfahren zum Nachweis von Antikörpern). Daher sind Infektionen mit anderen Serotypen möglich. Persistente Infektionen sollen dagegen nicht vorkommen.
BTV hat auch teratogene Wirkung, die aber anscheinend auf bestimmte Serotypen
beschränkt ist (?). Als Veränderungen beschrieben sind Schwäche, Katarakt,
Arthrogryposis, Hydranencephalie.
Klinische Erscheinungen:
Die Inkubationszeit beträgt nach experimenteller Infektion
2-15 Tage, meist 4-7 Tage. Andere Angaben sind 1 - 8 Tage bei Schafen und 5 - 12 Tage bei Rindern. Der Verlauf ist sehr variabel. Subklinische
Infektionen sind häufig. Zunächst kommt es zu mehrtägigem Fieber. Dann folgt
Hyperämie der Maul- und Nasenschleimhaut sowie der Haut um das Flotzmaul und in
den Ohren. Speicheln, Tränenfluss und Nasenausfluss, Ödeme im Bereich von Kopf,
Kehlgang und Hals, Petechien auf den Schleimhäuten. In schwerwiegenderen Fällen
treten Erosionen und Nekrosen der Schleimhäute des Kopfes auf, die denen bei BKF
sehr ähneln. Die Zunge kann stark anschwellen und zyanotisch werden (″blue
tongue“). Die so betroffenen Tiere fressen nicht und werden bald schwächer.
Lungenödem kann zu perakuten Todesfällen führen.
Blutungen in die Klauenlederhaut können Anlass zu Lahmheit geben, später zu
chronischem Ausschuhen.
Mitunter tritt bei Schafen wegen Degeneration und Nekrose von Halsmuskeln
Torticollis auf.
Die Symptome sind bei Kühen von der Art her ähnlich, aber
in aller Regel weit weniger ausgeprägt. Nach Beobachtungen "vor Ort" können aber auch erhebliche wirtschaftliche Schäden mit einer Bestandsinfektion verbunden sein, die durch starken Rückgang der Milchleistung, Nachgeburtsverhaltungen, Fruchtbarkeitsstörungen und Kümmern (letztlich mit der Notwendigkeit der Euthanasie) verursacht werden. Ob derartige Probleme eindeutig der BTV-Infektion direkt oder indirekt (über Verminderung der Resistenz gegenüber anderen Infektionen) zuzuschreiben sind, ist naturgemäß nicht in jedem Fall klärbar.


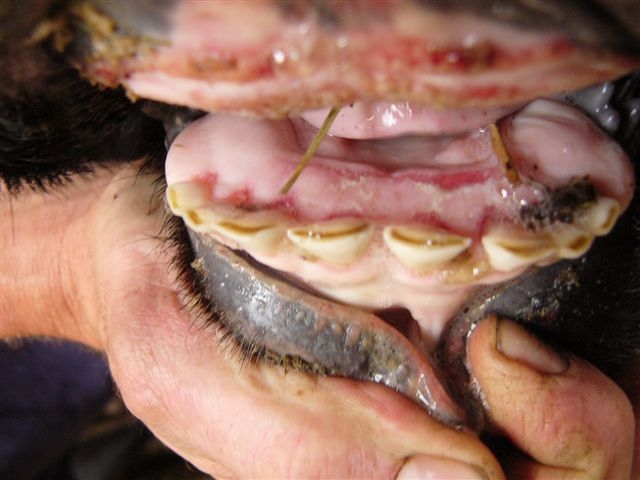
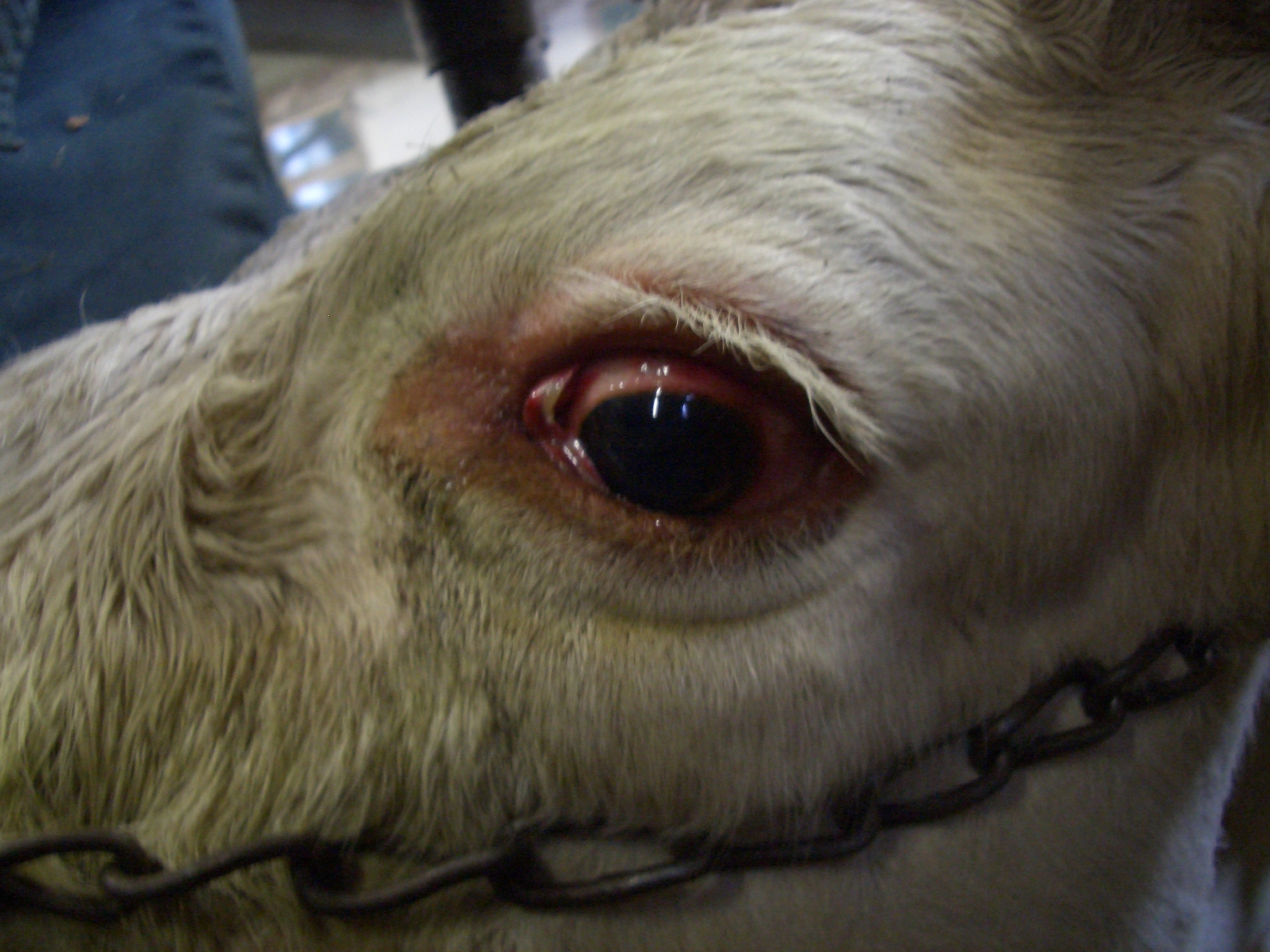
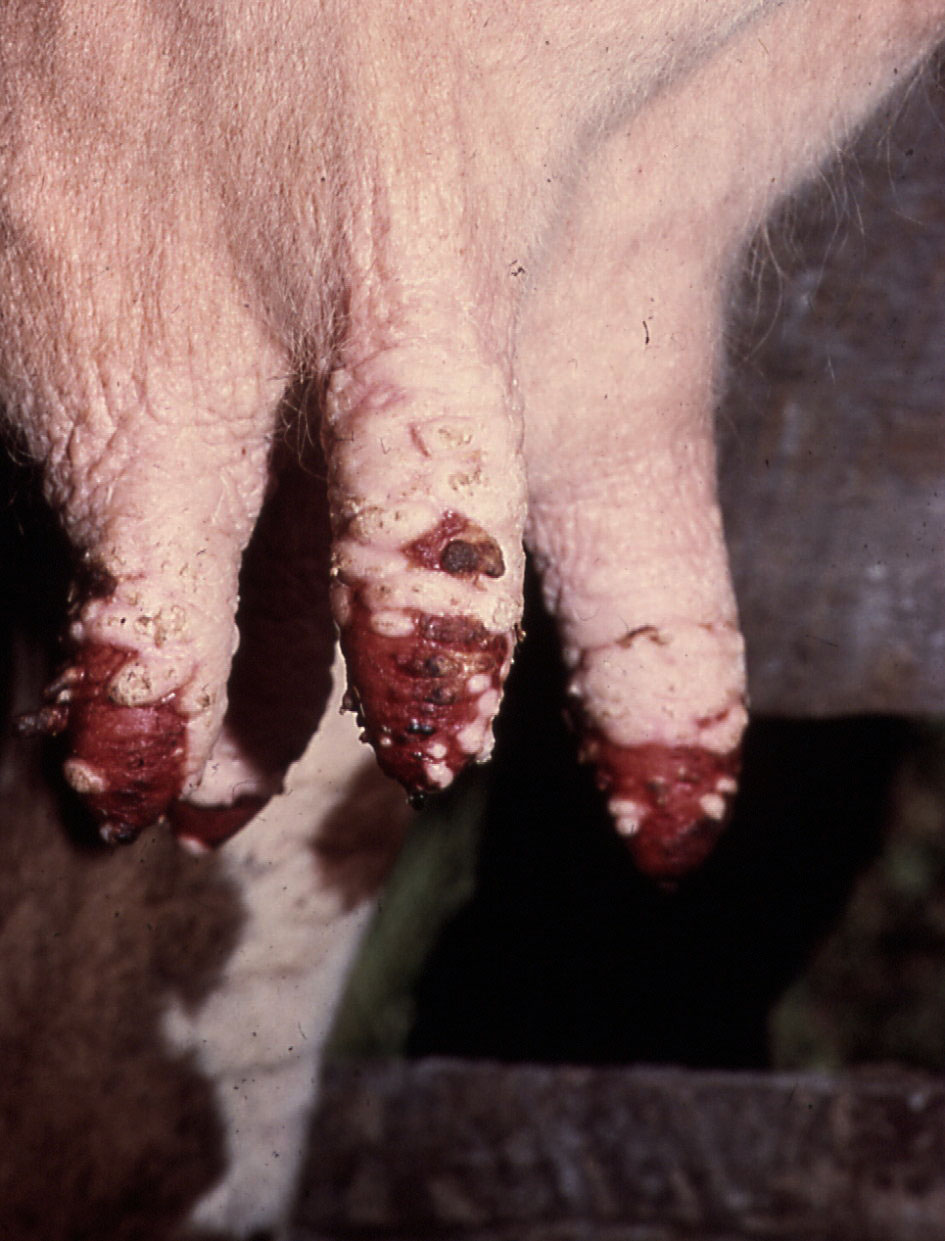
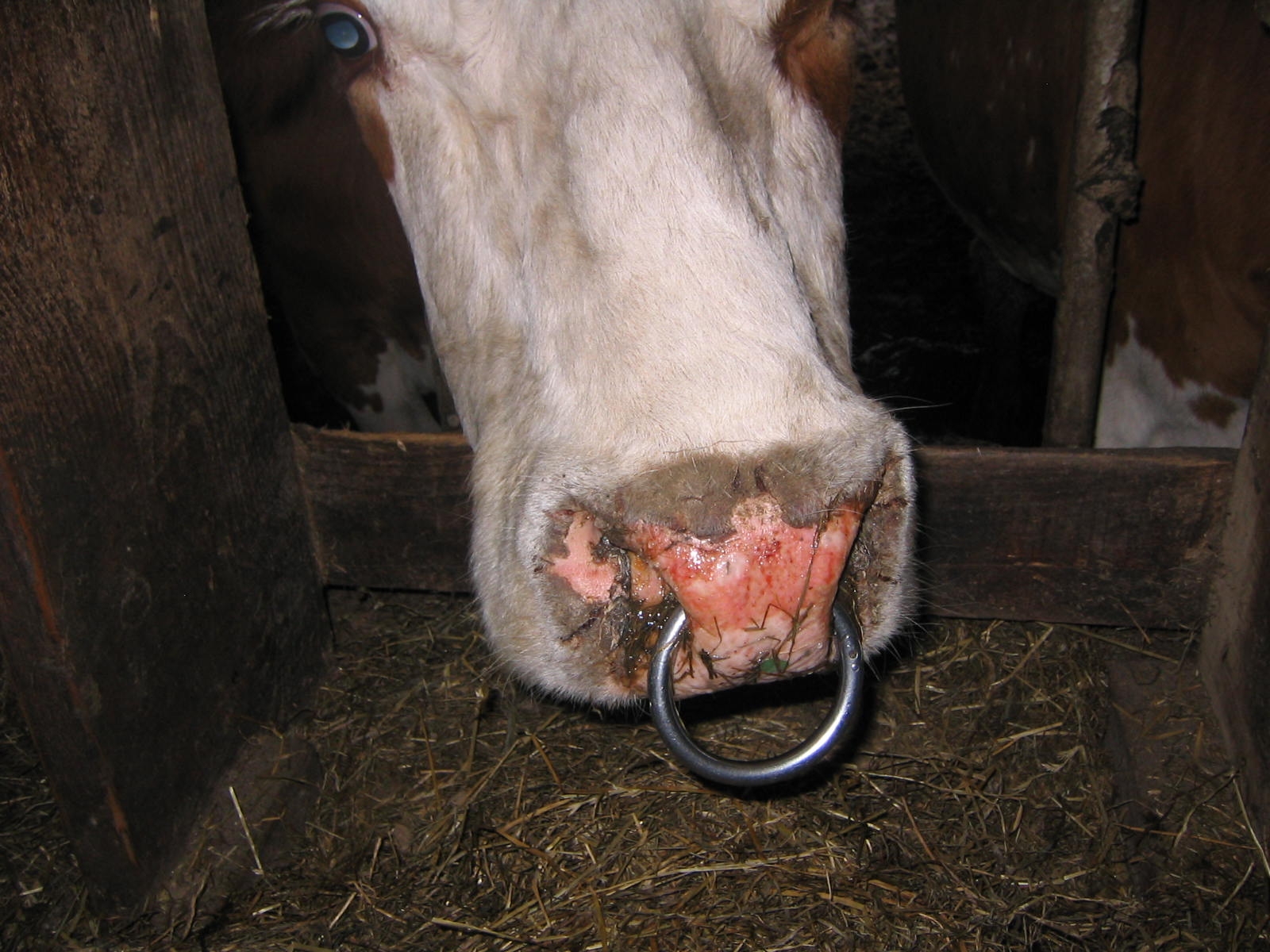
Bild oben links: Euter einer Kuh mit starken Veränderungen an den Zitzen
Bild oben rechts: Flotzmaul mit Erosionen, Nasenausfluss
Bild unten links: Gingiva mit Erosionen
Bild unten rechts: Hyperämie der Konjunktiven
Für die Überlassung der Bilder danken wir dem Veterinäramt des Kreises Düren und Dr. H. Dahmen, Prüm
Diagnostik:
In ausgeprägten Fällen, die vor allem bei Schafen zu erwarten sind, gibt die
klinische Symptomatik hinreichende Hinweise und damit Anlass zur Anzeige.
Von verdächtigen Tieren sind Blutproben (ca. 5 ml EDTA-Blut) an das
Referenzlabor für Orbiviren, Institut für Virusdiagnostik, FLI, Boddenblick 5a,
17493 Greifswald – Insel Riems, nach vorheriger Anmeldung (038351-7-201)
gekühlt, aber nicht gefroren, einzuschicken. Spezifische BTV-Antikörper werden meist mit einem kompetitiven ELISA nachgewiesen. Der direkte Nachweis der Infektion wird mit PCR erbracht. Dabei ist zu berücksichtigen, dass ein positives Ergebnis dieser Untersuchung nicht gleichbedeutend mit der Anwesenheit von noch infektionsfähigem Virus ist.
Differenzialdiagnose:
Schafe: Photosensibilisierung, Lippengrind, Moderhinke.
Rinder: Photosensibilisierung, MD, BKF, IBR, MKS; bei Missbildungen:
intrauterine BVDV-Infektion
Therapie:
Da es sich um eine
anzeigepflichtige Tierseuche handelt, ist bei Verdacht der Amtstierarzt
einzuschalten. Ätiologische Therapie ist gemäß der Natur des Erregers nicht
möglich. Antiphlogistika, Pflege und Verhinderung von bakteriellen
Sekundärinfektionen.
Prognose:
Bei Schafen wird die Letalität mit ≤ 30 % angegeben.
Rinder erholen sich nach dem meist milden Verlauf in aller Regel, tödlicher Verlauf ist aber möglich.
Vakzination ist möglich und wird seit Sommer 2008 auch bei Hauswiederkäuern durchgeführt.
Bekämpfung:
Die Erkrankung und der Verdacht sind anzeigepflichtig.
Es gibt eine „Verordnung zum Schutz gegen die Blauzungenkrankheit“ vom 22. März
2002 mit vielen Änderungen. Monitoring über repräsentative Stichproben von Haus- und Wildwiederkäuern wurde angeordnet.
In endemisch betroffenen Gebieten ist die Bekämpfung auf die Reduktion
wirtschaftlicher Schäden gerichtet, da eine Tilgung nicht möglich ist.