5 Blutgase und Säure-Basen-Haushalt
Physiologie und Pathophysiologie
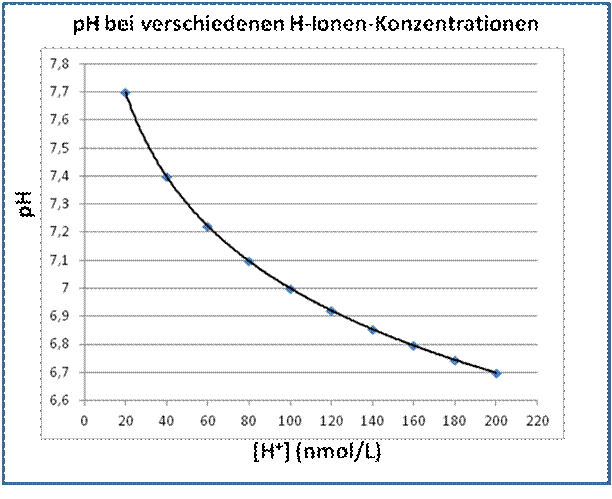
Da die pH-Skala eine logarithmische ist, erscheint der Bereich, in dem das (oder der) pH des Blutes mit dem Leben vereinbar ist (ca. 6,8 bis 7,8) relativ eng. Tatsächlich ist aber die H-Ionenkonzentration bei pH 6,7 10mal so hoch wie bei pH 7,7.

Abb. 5.1: H-Ionenkonzentration (nmol/L) und pH
Mechanismen der Homöostase der H+-Konzentration
1. Chemische Pufferung durch extrazelluläre und intrazelluläre Puffer. HCO3- ist wichtigster extrazellulärer Puffer, kann aber CO2 nicht puffern. Intrazelluläre Puffer: Proteine, Phosphate, Hb. Weitere Puffer: Knochen
2. Regulation des CO2-Partialdrucks durch Veränderung der Respiration
3. Kontrolle der HCO3-Konzentration durch Veränderung der renalen HCO3-Ausscheidung
Mengenmäßig macht Kohlensäure über 99 % der pro Zeiteinheit endogen anfallenden Säuren aus. Sie wird sehr rasch über die Lungen ausgeschieden. Die übrigen („fixen“) Säuren werden relativ langsam über die Nieren ausgeschieden.
Ein in der klinischen Chemie häufig verwendeter Begriff ist die Basenabweichung (engl.: base excess, BE). Definition: Verbrauch an starker Säure oder Lauge (in mmol/L) zur Titration von Blut unter Sauerstoffsättigung, bei CO2-Partialdruck von 40 mm Hg und bei 37 °C bis pH 7,40. Das Referenzintervall liegt etwa bei 0 ± 2,5 mmol/L (im venösen Blut). Negativer Basenexzess wird auch als Basendefizit (BD) bezeichnet. Der physiologische BE ist tierartlich etwas unterschiedlich.
Die Besprechung von metabolischer Alkalose und Azidose basiert auf der Henderson-Hasselbalch-Gleichung. Alternative Modelle zur Beschreibung des Säuren-Basen-Haushaltes wurden u.a. von P. STEWART (1983) und (in vereinfachter Form) P. CONSTABLE 1999) beschrieben.
Metabolische Alkalose:
Erhöhung des Blut-pH durch primären Anstieg der HCO3-Konzentration. Häufigste Ursache beim Rind ist Sequestration von salzsäurehaltigem Labmagensaft im Labmagen oder in den Vormägen (nach abomaso-ruminalem Reflux). Als Folge ist der Austausch von Hydrogenkarbonat- gegen Chloridionen im Dünndarm verringert, was wiederum dazu führt, dass im Plasma der Chloridspiegel sinkt, derjenige von Hydrogenkarbonat dagegen ansteigt. Die respiratorische Kompensation dieses Zustandes durch Reduktion des Gasaustausches (mit der Folge eines Anstiegs des Kohlendioxidpartialdrucks = respiratorische Azidose) ist wegen der Gefahr einer Hypoxämie nur bedingt möglich.
Metabolische Azidose:
Absinken des Blut-pH durch primäres Absinken der HCO3-Konzentration. Möglich sind Additionsazidose (zum Beispiel Erhöhung des Anfalls von organischen Säuren, vor allem von Milchsäure, aber auch Ketonkörper [Ketoazidose]) und Subtraktionsazidose (zum Beispiel Verlust von bikarbonatreichem Speichel bei Schlucklähmung oder von Dünndarmsekret bei Durchfall). Die Unterscheidung ist anhand der Anionenlücke (s. unten) möglich. Respiratorische Kompensation durch Steigerung der Abatmung von CO2 ist bis zu einem gewissen Grad möglich.
Aus einem niedrigen pH des Harns ist nicht hinreichend sicher auf das Vorliegen einer Blutazidose zu schließen. Hohes Harn-pH spricht jedoch gegen Vorliegen einer ausgeprägten Blutazidose.
Respiratorische Alkalose:
Erhöhung des Blut-pH durch primäres Absinken von pCO2. Diese Störung, die durch Hyperventilation ausgelöst werden kann, kann bei bestimmten Spezies (Mensch, Schaf: Festliegen?) zu Tetanie führen, weil der biologisch aktive, ionisierte Anteil des Kalziums im Blut abnimmt.
Respiratorische Azidose:
Absinken des Blut-pH durch primären Anstieg von pCO2 aufgrund von respiratorischer Insuffizienz.
Der direkteste Test für die Lungenfunktion ist die Messung der Sauerstoffsättigung des arteriellen Blutes. Sie beträgt normalerweise > 95 %.
Anionenlücke (engl.: Anion gap):
Differenz zwischen der Summe der Konzentrationen der beiden wichtigsten Kationen im Blut (Na+, K+) und der Summe der Konzentrationen der wichtigsten Anionen (Cl-, HCO3-), jeweils in meq/L. Es handelt sich um einer Rechengröße, die dadurch zustande kommt, dass in der Routinediagnostik nicht alle Anionen bestimmt werden.
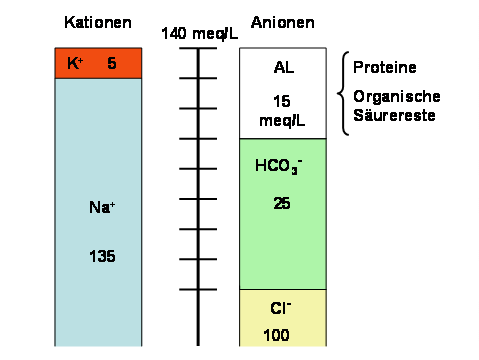
Abb. 5.2: Normale Anionenlücke
Bei Subtraktionsazidose (Verlust von HCO3) mit Speichel oder Faeces) wird der Verlust durch Cl ausgeglichen, und die Anionenlücke bleibt (mehr oder weniger) unverändert.
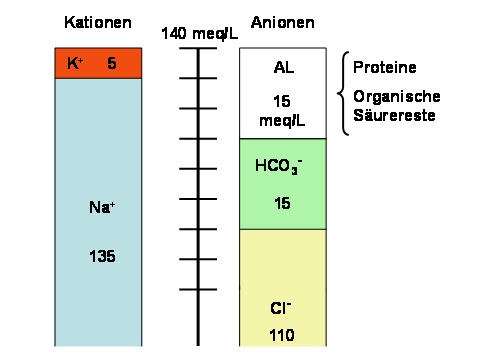
Abb. 5.3: Anionenlücke bei Subtraktionsazidose
Bei Additionsazidose steigt die Konzentration nicht flüchtiger organischer Säuren (vor allem Laktat) an. Die Anionenlücke wird dadurch größer.
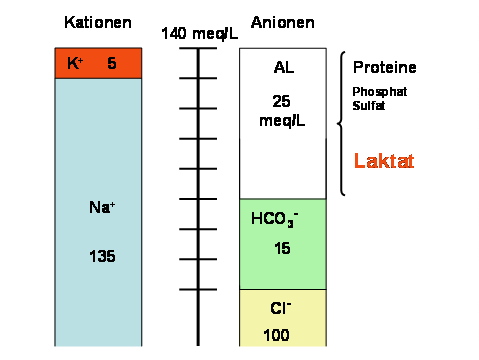
Abb. 5.4: Anionenlücke bei Additionsazidose
Indikationen zur Bestimmung der Blutgase
Verdacht auf Azidose, Erfolgskontrolle nach Azidosekorrektur
Bestimmungsmethoden
In Kliniken mit Blutgasanalysatoren, die meist auch weitere Parameter automatisch bestimmen. Tragbare Geräte für die ambulante Praxis sind verfügbar.
Referenzintervalle (für venöses Blut)
pH 7,35 - 7,45
pCO2 35 - 53 mm Hg
HCO3 22- 28 mmol/L
BE 0 ± 2,5 mmol/L
Letzte Änderung: 01. 09. 2015